Bacillus thuringiensis (Berliner)
  |
| Figura 1. Izquierda-Análisis micrografía de electrones (SEM) de B.. Bacterias Gram-positivas, formando esporas, bacteria del suelo (prokaryote) (Kunkel, 2017). Derecha- S. frugiperda afectada por B. thuringiensis (Bahena, 2020)
|
 |
Figura 2. Modo de acción de B. thuringiensis en insectos (Portalfruticola.com, 2018)
|
En un cultivo de Sorgo del Espinal Tolima se recolectaron 10 aislamientos nativos. Para la concentracion letal media (CL50) se obtuvo un 5,88 x 10ˉ⁴ (mg/ml de dieta). La cepa nativa M3008, fue la más tóxica, de modo que sería importante continuar con una identificación a nivel molecular de su contenido de genes Cry (Díaz, 2016).
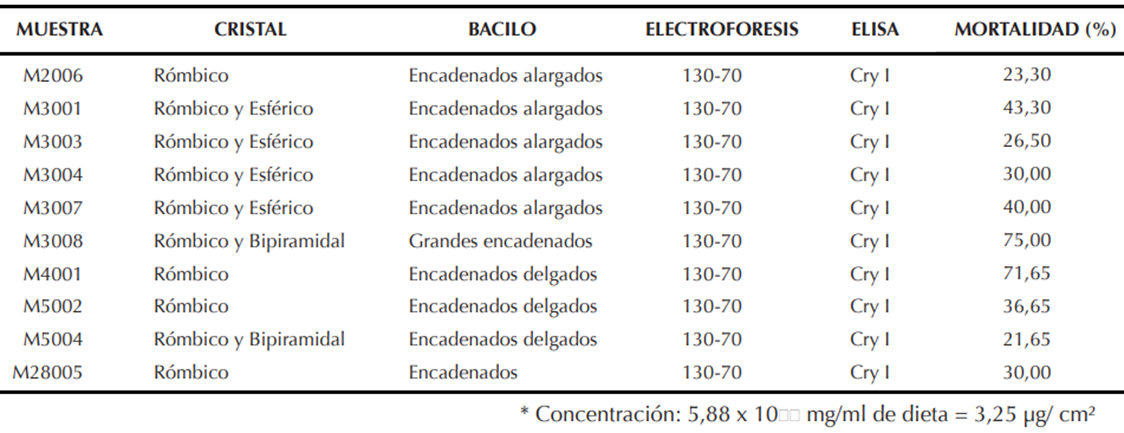 |
| Tabla 1. Caracteristicas del cristal, bacilo, prueba de electroforesis, inmunodetección (Elisa) y porcentaje de mortalidad de aislamientos nativos de B. thuriengiensis. En dieta purificada, en larvas de primer instar de S. frugiperda a las 120 horas |
- Respuesta de distintas poblaciones a la toxina Cry1Ab
Zenner de
Polanía et al., (2009) en su trabajo, obtuvieron la toxina, de un gen de Bt, donado por el Bacillus Genetic Stock Center (Ohio State University, EE. UU.), extraído de la cepa ECE-54 de E. coli. El tejido transgénico para la alimentación se obtuvo de maíz Yieldgard®.
 |
| Figura 3. Descripción de la tecnología Yielgard VT PRO (DEKALB, n.d.)
|
 |
Figura 4. Imagen tridimensional de la delta-entodoxina Cry1Ab (Alzate, Osorio, Flórez, & Dean, 2010)
|
Encontraron que hay una buena susceptibilidad de la población a la toxina: a medida que aumenta la dosis de la proteína Cry1Ab, aumenta la mortalidad larval; pero hay un incremento de la tolerancia a la toxina, lo cual podría estar relacionado con el aumento del área sembrada de maíz con tecnología Yieldgard®. La muestra analizada procedente de maíz convencional del departamento del Meta, arrojó una CL50 de 16,09 μg/mL de dieta. Es probable que una concentración del Cry1Ab a 15,37 ppm en hojas, de Granada (Meta), puedan controlar satisfactoriamente a S. frugiperda de esta zona. La concentración de la toxina en el follaje, mostró una concentración en hojas de 10,28 ppm, adecuada para el control del cogollero, mientras que en las espigas solamente fue de 1,66 ppm. La CL50 para la población de Anolaima es un 48,04% mayor, es decir, casi un tercio, que la estimada para el Tolima.
Se considera la posibilidad de resistencia cruzada a los diversos Crys del Bt, Cry1Ab y Cry1Ac. Se sugiere la urgencia de evaluaciones similares con el maíz transgénico que contiene el gen Cry1F, Herculex I (TC-1507), ya aprobado para su siembra en Colombia y con otras toxinas incorporadas, para incluir en un plan de manejo de resistencia el uso alterno de maíces que poseen otras toxinas con receptores diferentes a las toxinas mencionadas.
Photorhabdus luminescens subsp. akhurstii SL0708
Photorhabdus luminescens SL0708 es un simbionte de Heterorhabditis indica SL0708 (Rhabditida: Heterorhabditidae), recolectada de suelos colombianos. La cepa del simbionte bacteriano P. luminescens SL0708 se obtuvo de la coleccion de microorganismos de la Pontificia Universidad Javeriana. Para evaluar la patogenicidad, cada larva fue expuesta a 200 IJs de H. indica SL0708 (Salazar-Gutierrez et al., 2017)
  |
| Figura 5. Izquierda - Micrografía de luz fluorescente de nematodos Heterorhabditis. La bacteria simbiótica Photorhabdus luminescens en los intestinos de los gusanos ha sido marcada con proteína verde fluorescente (Markus, 2020). Derecha - Larvas de G. melonella muertas por Heterorhabditis presentan luminosidad en la oscuridad, debido a su bacteria simbionte, Photorhabdus sp. que contiene un gen de luminiscencia (Cap, 2017). |
La inyeccion bacteriana a diferentes concentraciones mostró una respuesta dependiente de la dosis con la mayor mortalidad asociada con una mayor concentracion de P. luminescens SL0708. La mortalidad resultó con dosis de 1x104 CFU/larva (Unidad formadora de colonias CFU), con cerca del 100% entre las 48 y 72 horas despues del tratamiento.
Los sintomas presentados en el insecto fueron: perdida de movimiento, incapacidad de alimentarse y diarrea. Además, cadaveres flacidos y un tipico rojo colorido como resultado probable de antraquinonas y estilbenos producidas por P. luminescens. La infeccion y proliferacion en cuerpos larvales fue muy rapida y eficiente a juzgar por la alta bioliminescencia observada despues de la inyeccion bacteriana o del tratamiento con H. indica SL0708. La inyeccion de extractos bacterianos extracelulares en larvas resultó en una mortalidad acumulada de 65% a las 48 horas y de >93% a las 72 horas. Con los extractos bacterianos extracelulares, la mortalida observada fue menor, no excediendo el 60%. Despues de la inyeccion y muerte con extractos bacterianos extracelulares, las larvas presentaron una coloracion rojiza y flacidez en cadaveres; con extractos intracelulares, color cafe oscuro, con signos caracteristicos de melanizacion.
 |
Figura 6. A) Rasgos de cadaveres larvales luego de la infeccion con Photorhabdus luminescens SL0708. B1. Larva control. B2. Larva despues de la inyeccion de P. luminescens SL0708. B) Extractos bacterianos de P. luminescens SL0708 inyectados a larvas de insectos causando la muerte. B1. Larva control. B2. Larva muerta despues de la inyeccion de extracto intracelular. B3. Larva muerta depsues de la inyeccion de extracto extracelular.
|
FACTORES DE PATOGENICIDAD ASOCIADOS CON P. luminescens SL0708: Desde una rapida proliferacion sistemica bacteriana obserbada y propagacion en todos los compartimientos larvales sobre la infeccion con P. luminescens SL0708, se sugiere la necesidad de una actividad hidrolitica alta como un actor indispensable para la patogenicidad. La actividad hemolitica se observó despues de 48h de incubacion, especificamente hemolisis beta, evidenciada como zonas claras alrededor de colinias de P. luminescens SL0708. La produccion de sideroforos mostro resultados positivos despues de 48h de incubación. Esta patogenicidad puede determinarse principalmente por factores de virulencia de naturaleza proteica, como esterasas, proteasas, ureasas y hemolisinas. Igualmente, esta bacteria presenta un 99,5% de secuencia similar que P. luminescens subsp. akhurstii FRG04.
Caracterización molecular y análisis de libertad de operación de híbridos de maíz de variedades colombianas y genéticamente modificadas
HERCULEX® I, tambien conocido como maíz TC1507, es un maiz comercial disponible, relacionado con el gen cry1F. Contiene un gen que confiere resistencia, lleva el gen cry1F de Bacillus thuringensis var. Aizawi. Este gen codifica para la proteina Cry1F, clasificada como una delta-endotoxina. También contiene el gen pat, que codifica para la fosfinotricina acetiltransferasa (pat, phosphinothricin acetyltransferase), junto con el promotor del virus del mosaico del coliflor (CaMV35S); cataliza la acetilacion de la fosfinotricina (ingrediente activo en herbicidas a base de glufosinato de amonio), haciendola inactiva como herbicida (Jiménez-Bareto, Chaparro-Giraldo, Mora-Oberlaender, & Vargas-Sanchez, 2016).
 |
| Figura 7. Contexto ganadero citado en Catorce6.com (2019) |
La Federación Nacional de Cultivadores de Cereales y Oleaginosas (FENALCE) ha desarrollado experimentos de cruzamientos mendelianos entre genotipos colombianos de maíz y HERCULEX® I. Evaluaron dos lineas parentales, 81 (no modificado geneticamente) y 28 (geneticamente modificado-GM), y tres hibridos: 286×285, 288×287 y 289 × 290. En la linea parental GM 28 y los tres hibridos se observó varias bandas de pares de bases que hacen parte del gel cry1F; concluyendo que contienen los elementos transgenicos de HERCULEX® I. Se confirmó la transcripcion de genes cry1F y la proteina pat, y sus secuencias promotoras por PCR. Ninguno de estos estos elementos fueron detectados en la linea parental 81.
S. frugiperda causa notables daños en cultivos de maíz genéticamente modificados:
Un estudio realizado en el centro de investigacion de Nataima de Agrosavia, en El Espinal, Tolima, Colombia; ha reportado que el hibridos de maíz 30F35HR (con endotoxinas CP4 y Cry1F) ha sido geneticamente modificado con el gen Cry1F de B. Thuringiensis desarrollado para el control de Lepidopteros. Este genotipo registró la presencia de larvas, deduciendo que la endotoxina no ejerció un control total sobre las poblaciones. La etapa vegetativa presentó mayor población de larvas que, de no manejarse, se pueden presentar áreas con daño en un 52% de las plantas en el híbrido con Cry1F. Esto sugiere que, si las áreas de refugio y estrategias tal como un monitoreo de plagas no son establecidas, estos insectos podrían generar un alta resistencia a las plantas con la endotoxina Cry1F (Jaramillo-Barrios, Barragán Quijano, & Monje
Andrade, 2019).
 |
| Figura 8. Maíz Pionner 30f35vyhr (Croper.com,
2018) |
PRODUCTOS BIOINSUMOS REGISTRADOS POR EL ICA
 |
BITOXIBACILLIN WP
Bacillus thuringiensis var. thuringiensis 99.8 X 109UFC/g = 90.0 g/Kg Polvo mojable (WP) [link] |
 |
DIPEL WG
Bacillus thuringiensis var. kurstaki 1x109 UFC/ml Granulos dispersables (WG) [link] |
 |
THURICIDE HP WP
Bacillus thuringiensis var. kurstaki (SEROTIPOS IIIA Y IIIB) 1X1010UFC/g Polvo mojable (WP) [link] |
 |
XENTARI WG
Bacillus thuringiensis var aizawai 15000 UI Potencia/mg 3% Granulos dispersables [link] |
 |
JAVELIN WG
Bacillus thuringiensis var. kurstaki SEROTIPO 3A 3B 8X109 UFC/g (53 billones de unidades de Spodoptera/Kg) Gránulos dispersables (WG) [link] |
REFERENCIAS
[1] Alzate, O., Osorio, C., Flórez, Á., & Dean, D. H. (2010). Participation of Valine 171 in -Helix 5 of Bacillus thuringiensis Cry1Ab -Endotoxin in Translocation of Toxin into Lymantria dispar Midgut Membranes. Applied and Environmental Microbiology, 76(23), 7878–7880. Retrieved from https://www.researchgate.net/publication/47300309_Participation_of_Valine_171_in_-Helix_5_of_Bacillus_thuringiensis_Cry1Ab_-Endotoxin_in_Translocation_of_Toxin_into_Lymantria_dispar_Midgut_Membranes
[2] Bahena, F. (2020). Manejo Agroecológico del gusano cogollero del Maíz en México. Retrieved from Firosanidad website: https://www.intagri.com/articulos/fitosanidad/manejo-agroecologico-del-gusano-cogollero-del-maiz-en-mexico
[3] Cap, G. B. (2017). Nematodos benéficos. III SEMINARIO – Microorganismos Benéficos y Otros Bioinsumos. Usos En La Horticultura., p. 38. Retrieved from https://inta.gob.ar/sites/default/files/inta_seminario_microorganismos_nematodos_beneficos-guillermo_cap.pdf
[4] Catorce6.com. (2019). El ICA autorizó la siembra de la primera semilla transgénica hecha en Colombia. Retrieved from Investigación website: https://www.catorce6.com/investigacion/17667-el-ica-autorizo-la-siembra-de-la-primera-semilla-transgenica-hecha-en-colombia
[5]Croper.com. (2018). Maíz Pionner 30f35vyhr. Retrieved from Semillas - Cereales website: https://www.croper.com/products/26-semillas/3247-cereales/2141-maiz-pionner-30f35vyhr
[6]DEKALB. (n.d.). YIELDGARD VT PRO. Retrieved from Tecnologías website: https://www.dekalb.com.co/es-co/tecnologias/yieldgard-vt-pro.html
[7] Díaz, J. E. (2016). Acción de cepas nativas de Bacillus thuringiensis (Berliner), como control biológico de Spodoptera frugiperda (J.E. Smith). Lepidoptera: Noctuidae. TEMAS AGRARIOS, 21(2), 86–91. Retrieved from https://repositorio.unicordoba.edu.co/bitstream/handle/ucordoba/323/904-1714-2-PB.pdf?sequence=1&isAllowed=y
[8] Jaramillo-Barrios, C. I., Barragán Quijano, E., & Monje Andrade, B. (2019). Populations of Spodoptera frugiperda (Lepidoptera: Noctuidae) cause significant damage to genetically modified corn crops. Revista Facultad Nacional de Agronomía, 72(3), 8953–8962. https://doi.org/10.15446/rfnam.v72n3.75730
[9] Kunkel, D. (2017). Análisis micrografía de electrones (SEM) de Bacillus thuringiensis. Bacterias Gram-positivas, formando esporas, bacteria del suelo (prokaryote). Bacillus thuringiensis producción. Retrieved from Science Photo Library website: https://www.alamy.es/analisis-micrografia-de-electrones-sem-de-bacillus-thuringiensis-bacterias-gram-positivas-formando-esporas-bacteria-del-suelo-prokaryote-bacillus-thuringiensis-produccion-image335262015.html
[10] Markus, R. (2020). Beneficial nematodes, fluorescent micrograph. Retrieved from Science Photo Library website: https://www.sciencephoto.com/media/892013/view/beneficial-nematodes-fluorescent-micrograph
[11]Portalfruticola.com. (2018). El control de insectos con Bacillus thuringiensis. Retrieved from https://www.portalfruticola.com/noticias/2018/05/11/el-control-de-insectos-con-bacillus-thuringiensis/
[12] Salazar-Gutierrez, J. D., Castelblanco, A., Rodriguez-Bocanegra, M. X., Teran, W., & Saenz-Aponte, A. (2017). Photorhabdus luminescens subsp. akhurstii SL0708 pathogenicity in Spodoptera frugiperda (Lepidoptera: Noctuidae) and Galleria mellonella (Lepidoptera: Pyralidae). Journal of Asia-Pacific Entomology, 20, 1112–1121. Retrieved from https://www.sciencedirect.com/science/article/pii/S1226861517300122
[13] Zenner de Polanía, I., Arévalo Maldonado, H. A., Mejía Cruz, R., & Díaz Sánchez, J. L. (2009). Spodoptera frugiperda: respuesta de distintas poblaciones a la toxina Cry1Ab. Revista Colombiana de Entomología, 35(1), 34–41. Retrieved from http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-04882009000100007&lng=en&nrm=iso&tlng=es





Comentarios
Publicar un comentario